温暖的橘红色灯光、醇厚的原麦啤酒香,无不透漏着乡村布鲁斯恰到好处的慵懒。在美国德克萨斯州的一家乡村音乐俱乐部里,James·P·Allison教授正在陶醉地吹奏着手中的布鲁斯口琴,和他同台的是蓝调口琴大师Mickey Raphael,以及乡村音乐传奇人物Willie Nelson。
这一天时值2016年。口琴大师Allison教授的另一重身份是肿瘤免疫疗法的全球先驱之一。在他的研究带领下,全球第一款免疫检查点抑制剂——CTLA-4抑制剂ipilimumab(伊匹木单抗)已于2011年在美国上市[1]。2015年,他因此斩获了闻名世界的美国拉斯科医学奖。拿奖拿到手软的Allison教授此刻只差一个诺贝尔奖。
然后,三年后的一个清晨,Allison教授的儿子告诉他:Hi老爸,你得了诺奖!
大学本科时代的一次试验,让Allison彻底迷上了免疫学。在那次试验中他发现,患有白血病的小鼠在被天冬酰胺酶治愈后,再次注射癌细胞时,小鼠会对癌细胞产生抵抗力[2]。
到20世纪70年代的时候,Allison几乎把全部的时间和经费都押在了对T细胞的研究上。
1982年,Allison的团队通过制备能够被T细胞受体识别的单克隆抗体,对T细胞表面受体(TCR)结构的鉴定做出了重要贡献[3]。接着,在1992年,他和同事又阐明了T细胞激活除了需要TCR识别抗原之外,还需要另外一对共刺激因子CD28和抗原提呈细胞上的B7结合才能被完全激活[3]。
APC与T细胞的两对关键蛋白结合,激活T细胞
至此,人们终于窥见了免疫战士T细胞的部分真容。就在这个时候,另一种在T细胞表面表达的神秘蛋白受体CTLA-4也受到科学家的广泛关注。
CTLA-4受体属于免疫球蛋白家族,并且,它的配体也是B7。更令人惊讶的是,CTLA-4和B7结合的能力要远远高于T细胞激活的共刺激因子CD28!
那么CTLA-4究竟在T细胞的免疫活动中发挥什么作用,难道它也是T细胞激活的共刺激因子?Allison和众多科学家陷入了沉思。
1994年,Jeffrey Bluestone团队率先掀开了谜团,他们用抗体阻断了CTLA-4和B7的结合。结果发现,T细胞的增殖竟然增强了!免疫反应也显著增强。也就是说,CTLA-4通路的作用竟然是抑制免疫反应[4]!这个结果在1995年再次得到了验证,科学家发现:敲除了CTLA-4基因的小鼠会出现严重的自身免疫反应[5,6]。
原来,CTLA-4通路相当于一个刹车系统,它可以在激活的常规T细胞表面表达,也可以在调节性T细胞上表达。因为CTLA-4和B7的结合能力远高于CD28,所以CTLA-4的出现会严重抑制T细胞的激活[7]。
在弱TCR刺激的情况下,CTLA-4在细胞内储存,CD28与B7的结合占优势,成功激活T细胞,白细胞介素-2产生,T细胞增殖和存活率增加。
在强TCR刺激的情况下,CTLA-4从细胞内向细胞表面转运,CTLA-4水平增加,与CD28竞争,代替CD28与B7结合,减少白细胞介素-2的产生和T细胞增殖活化(如图中下半部分所示)。
CTLA-4免疫通路的免疫抑制功能显然是把“双刃剑”, CTLA-4通路抑制T细胞激活的后果是一方面能够调节T细胞激活的程度,避免自身免疫疾病的发生,另一方面又会让病原体或是癌细胞这些坏家伙有可乘之机。事实上,肿瘤的发生发展的确与T细胞激活不足有关系。那么,如果CTLA-4这个刹车系统被抑制,T细胞能否重新振作去猎杀癌细胞呢?
痴迷于T细胞研究的Allison教授当然不会错过这个灵感。1994年12月,Allison就和他实验室的博士后开始了小鼠实验,注射癌细胞形成肿瘤后,一组小鼠用CTLA-4单克隆抗体进行治疗,一组用安慰剂。Allison预想CTLA-4单抗应该能让肿瘤的生长稍微减慢一些,但结果肿瘤居然消失了!而且,接受过治疗的小鼠似乎对癌细胞产生了“抗性”,这表明阻断CTLA-4的疗法具有长效作用。
1996年,他的团队在《科学》上发表论文,率先在小鼠中证明,使用CTLA-4抑制剂可以增强小鼠免疫反应,抑制肿瘤的发生发展。这个开天辟地的论文立刻在学术界引起了轰动[8]!
免疫治疗的大幕缓缓开启,一道未来之光照进了焦灼的肿瘤治疗领域。
反戈一击,掀开癌症治疗的新纪元
对Allison来说,1996年充满着反转。他的实验成果虽然在学术界获得巨大的关注,但他想进一步开发CTLA-4药物的时候,却遭遇了制药界泼来的一盆盆冷水。
这当然事出有因。自从20世纪70年代开始,就有科学家希望利用免疫系统去攻击癌症,但是经过二十多年的等待与蹉跎,制药界的热情早已慢慢被冷却。
对Allison教授来说,退却是一种更大的恐惧。
Allison的整个青少年时代,都被癌症的阴影笼罩。在他11岁的时候,母亲因为淋巴瘤病逝。紧接着,15岁的时候,Allison的叔叔死于肺癌。许多年之后,他的大哥死于前列腺癌。在哥哥的葬礼结束一周之后,Allison发现自己也得了前列腺癌,十年后,他又被诊断为黑色素瘤。但万幸的是,Allison所患的两种癌症在很早期就被诊断出来,从而得以根治[2]。
从癌症的魔爪中死里逃生,谁会放弃这反戈一击的绝佳机会呢?
转机出现在一次学术会议上。Allison遇到了一个小型制药公司NeXstar的免疫学家Korman。Korman对这项技术充满了热情,经过商谈,NeXstar在1998年的时候购买了CTLA-4抑制剂的专利。但是没过多久,NeXstar就被吉利德收购,Korman也随后加入了Medarex公司[2]。
但是Korman并没有放弃CTLA-4抑制剂。2002年,他说服Medarex公司接手了CTLA-4抑制剂的专利。由于Medarex公司掌握当时最先进的转基因小鼠技术,因此具备生产单抗的绝佳条件。
Medarex在2005年时与百时美施贵宝(BMS)开展全球合作,共同开发和商业化首个CTLA-4抑制剂——ipilimumab,2009年时又被BMS收购。BMS也因此获得了ipilimumab的完全所有权[9]。
此后不久,首个CTLA-4抑制剂ipilimumab迎来了III期临床试验[10]。研究人员将676名无法手术的III期或IV期黑色素瘤患者分成3组,分别为:ipilimumab和GP100癌症疫苗单药组,以及ipilimumab-GP100癌症疫苗联合治疗组。(GP100癌症疫苗是一种合成的癌症肽疫苗,包含“糖蛋白100”黑色素瘤抗原的一段氨基酸,在早期试验中表现出了抗黑色素瘤的效果)
试验结果显示,联合治疗组与ipilimumab组的生存率始终高于GP100组,中位总生存期也均远超过GP100组[10]。基于这个振奋人心的结果,美国FDA于2011年批准了ipilimumab用于治疗无法手术切除的,或是转移性的黑色素瘤[1],历史上首个癌症免疫检查点抑制剂由此诞生。
从未轻言放弃的Allison教授,改变了潮水的方向,癌症的免疫治疗至此迈入了新纪元。
生命的奇迹,超级幸存者出现了
对蓝调音乐的痴迷,或许显示了Allison教授性格的另一面,那个不同于充满独立、理性、冒险精神的科学家特质的多愁善感的一面。
Allison教授的妻子Padmanee 2016年在接受《纽约时报》采访时说,“Allison几乎每次见到患者,都会掉眼泪[11]。”
2004年,一个22岁的女孩Sharon被诊断为黑色素瘤四期,肺转移。化疗对她已经毫无作用,活下来的可能非常渺茫。抱着最后一丝希望,Sharon参加了Allison组织的ipilimumab的临床试验[11]。
被绝望笼罩的Sharon从没想过自己会亲历所谓的奇迹。在三个月内经过四次注射ipilimumab之后,她转移到左肺的肿瘤就奇迹般地缩小了60%!在接下来的几个月,肿瘤继续惊人地缩小。
直到最终,医生告诉她,“Sharon,你身上的癌细胞被全部消灭了,你已经痊愈了!”
Allison在Sharon康复后迫不及待地与这个死里逃生的姑娘见面了。当时Sharon的父母和丈夫都在场,在场的每个人都只是不停抹泪。
Sharon紧紧地抱着Allison,她不知道如何用语言去表达被判死刑之后重获生命的感激。
Allison也紧紧地抱着Sharon,他也不知道如何去用语言表达拯救一个年轻生命的炙热的喜悦。
在他们见面之后的第二年,Allison收到了Sharon第一个孩子的照片,几年之后,他又收到了Sharon第二个孩子的照片。
当然,并不是所有使用ipilimumab的患者都能像Sharon一样幸运,最终能够康复。但是多项临床试验患者的长期随访结果显示,接受ipilimumab治疗的患者中,出现了一批生存期长达10年的“超级幸存者” [12]!
在ipilimumab出现前,晚期黑色素瘤患者的历史中位总生存期大约为8-10个月,而5年生存率仅为10%[13],而根据2013年欧洲癌症大会(ECC2013)上发布的针对患者总生存率的分析结果,ipilimumab以一己之力,大幅拉高了患者的生存率[12]。
除了黑色素瘤以外,ipilimumab也在其他癌症中进行了尝试,例如非小细胞肺癌、前列腺癌和尿路上皮癌等等,都取得了初步的成功。
神之交汇,当CTLA-4遇到PD-1抑制剂
2018年的诺贝尔生理学和医学奖花落免疫治疗,手捧奖杯的两位科学家Allison和本庶佑分别开启了CTLA-4和PD-1两大免疫检查点的先河。而这两条河流也已经出现了神之交汇。
CTLA-4和PD-1同为免疫检查点,但其实它们作用于T细胞出征的不同阶段,相比CTLA-4的早出手,PD-1更多则是在T细胞激活后迁移到肿瘤附近,准备击杀肿瘤的时候横插一脚,简直是虎口拔牙。
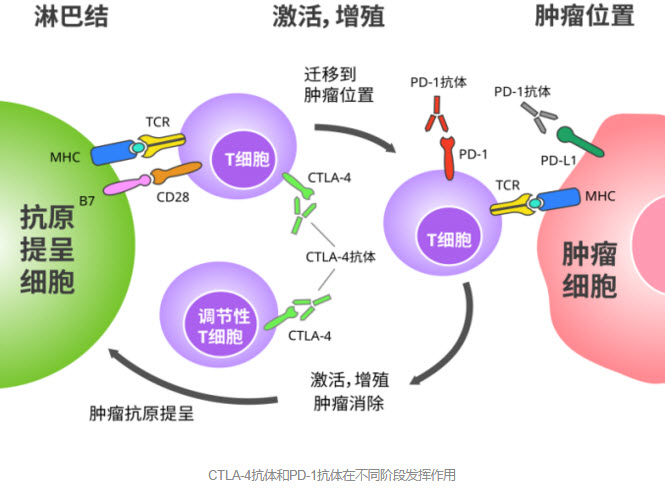
除了作用阶段不同外,CTLA-4和PD-1的分布也不同,CTLA-4只存在于T细胞上,而PD-1在T细胞、B细胞和骨髓细胞上都有广泛的表达,在它们被抑制后,细胞因子水平的变化也不相同。
所以从理论上来说,同时抑制CTLA-4和PD-1通路能够从不同角度调节T细胞活性,可能带来更高的响应率和更强的抗肿瘤效果[7]。
在临床前研究中,这个想法得到了初步的验证,而临床试验的结果也没有让人失望。2015年,一项II期临床试验结果表明[14],在BRAF V600野生型黑色素瘤患者中,与ipilimumab 单药治疗相比,ipilimumab + nivolumab联合治疗的响应率有了极大的提高,完全缓解的患者比例也具有绝对优势。
同年,FDA就批准了ipilimumab + nivolumab联合治疗用于治疗BRAF V600野生型黑色素瘤[15]。这还仅仅是一个开端。
截止2020年5月,ipilimumab + nivolumab联合治疗总共在FDA手中斩获了五个适应症,它们分别是:BRAF V600野生型和突变阳性的不可切除或转移性黑色素瘤[16];中至低风险晚期肾细胞癌[17];接受过化疗但肿瘤持续进展的MSI-H/dMMR转移性结直肠癌[18];接受过索拉非尼治疗的肝细胞癌[19];以及刚刚获批的转移性非小细胞肺癌[20]
就在这个月,ipilimumab + nivolumab联合治疗再次获批新适应症,用于一线治疗转移性非小细胞肺癌(图片来源:FDA官网)
能够在联合治疗中获益的患者还将增加,例如在去年美国癌症研究协会(AACR)年会上公布最新结果的神经内分泌瘤[21]。
“我认为做科学研究,最重要的是要去叩问那些最根本而又至关重要的问题。并且你需要时不时地,给自己倒上一杯酒,把脚放在桌子上,然后问:我们如何更好地利用这些知识和发现。”
这不仅是Allison教授给科学研究者的建议,更是他对几十年来卓越工作的精辟阐释。癌症免疫治疗的路还很长,Allison和他的朋友们仍旧在努力着。
目前尚无CTLA-4抑制剂在中国大陆获批。
参考资料:
[1]https://www.drugs.com/newdrugs/fda-approves-yervoy-late-stage-melanoma-2569.html
[2]http://www.whatisbiotechnology.org/index.php/people/summary/Allison
[3]https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4607124/
[4] Walunas T L, Lenschow D J, Bakker C Y, et al. CTLA-4 can function as a negative regulator of T cell activation[J]. Immunity, 1994, 1(5): 405-413.
[5] Waterhouse P, Penninger J M, Timms E, et al. Lymphoproliferative disorders with early lethality in mice deficient in Ctla-4[J]. Science, 1995, 270(5238): 985-988.
[6] Tivol E A, Borriello F, Schweitzer A N, et al. Loss of CTLA-4 leads to massive lymphoproliferation and fatal multiorgan tissue destruction, revealing a critical negative regulatory role of CTLA-4[J]. Immunity, 1995, 3(5): 541-547.
[7]Buchbinder E I, Desai A. CTLA-4 and PD-1 pathways: similarities, differences, and implications of their inhibition[J]. American journal of clinical oncology, 2016, 39(1): 98.
[8]Leach D R, Krummel M F, Allison J P. Enhancement of antitumor immunity by CTLA-4 blockade[J]. Science, 1996, 271(5256): 1734-1736.
[9]Ipilimumab. Drugs R&D. 2012;10(2):97–110.
[10]Hodi F S, O'Day S J, McDermott D F, et al. Improved survival with ipilimumab in patients with metastatic melanoma[J]. New England Journal of Medicine, 2010, 363(8): 711-723.
[11]http://nautil.us/issue/65/in-plain-sight/the-rise-of-cancer-immunotherapy
[12]https://www.ecco-org.eu/Amsterdam2013/Global/News/ECC-2013-Press-Releases-EN/2013/09/Longest-follow-up-of-largest-number-of-melanoma-patients
[13] Garbe C, Eigentler T K, Keilholz U, et al. Systematic review of medical treatment in melanoma: current status and future prospects[J]. The oncologist, 2011, 16(1): 5-24.
[14] Postow M A, Chesney J, Pavlick A C, et al. Nivolumab and ipilimumab versus ipilimumab in untreated melanoma[J]. New England Journal of Medicine, 2015, 372(21): 2006-2017.
[15]https://www.drugs.com/newdrugs/bms-receives-fda-approval-opdivo-nivolumab-yervoy-ipilimumab-regimen-braf-v600-wild-type-melanoma-4271.html
[16]https://www.drugs.com/newdrugs/bristol-myers-squibb-s-opdivo-nivolumab-yervoy-ipilimumab-regimen-receives-expanded-fda-approval-4332.html
[17]https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm604685.htm
[18]https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm613227.htm
[19]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-nivolumab-and-ipilimumab-combination-hepatocellular-carcinoma
[20]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-nivolumab-plus-ipilimumab-first-line-mnsclc-pd-l1-tumor-expression-1
[21]https://www.abstractsonline.com/pp8/#!/6812/presentation/9840
