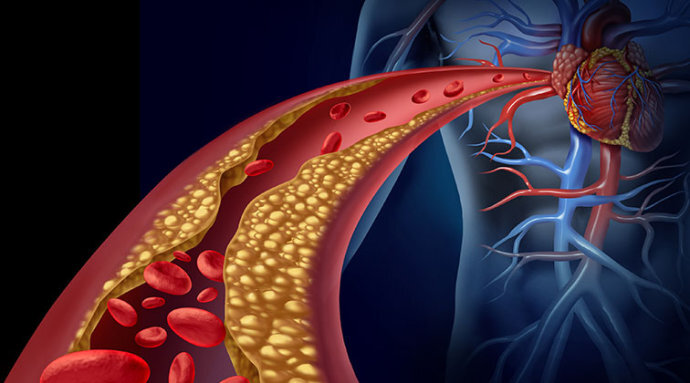
动脉粥样硬化性心血管疾病(ASCVD)是以动脉粥样硬化为病理基础的一系列疾病总称,是全球范围内致残和致死的主要原因,尽管在过去的许多年,研究人员在不断尝试新的有效治疗方法,但仍然有数百万人正在遭受ASCVD带来的痛苦和困扰。
《美国预防心脏病学杂志》(ASPC)在线发表一项综述,研究人员回顾了既往动脉粥样硬化性心血管疾病临床实践情况,并指出低密度脂蛋白胆固醇(LDL-C)是血管毒素,危害巨大,需要采用更早、更深入、更精准的方法,以降低ASCVD的发病风险。
LDL-C是如何一步步成为血管毒素的?
LDL导致ASCVD与免疫炎症反应、坏死核心形成和纤维帽降解导致的斑块破裂、裂隙和侵蚀等因素有关。
LDL具有被动滤过和主动跨内皮转运的功能,吸烟、糖尿病、高血压等因素会损伤动脉壁内皮功能,使LDL进入内膜后在酶或非酶的作用下形成氧化的LDL(oxLDL),oxLDL可引起局部及全身免疫炎症反应。LDL进入内膜后不能及时离开,造成血管内皮下脂质蓄积,滞留的LDL在动脉壁内皮下发生氧化修饰,进一步发生变性,造成细胞外脂质堆积,形成细胞外胆固醇结晶。LDL在血管壁的修饰和异常积蓄可诱发复杂免疫炎症反应,导致斑块不稳定,容易发生破裂。
家族性高胆固醇血症为LDL导致ASCVD提供了遗传学证据,患者表现为LDL-C水平显著升高和过早发生动脉粥样硬化。家族性高胆固醇血症主要分为两种,分别是低密度脂蛋白受体(LDLR)或apoB基因功能缺失突变,以及前蛋白转化酶枯草溶菌素/kexin9(PCSK9)基因发生功能突变,引起LDLR降解。两种基因突变的发现也为LDL-C降低ASCVD风险提供了药物靶点。
LDL-C水平升高是动脉粥样硬化病变形成的致命性危险因素。大量临床证据表明,降低血液中的LDL-C水平有助于减少斑块内LDL蓄积及诱发炎症和坏死核心的形成,促进斑块逆转和稳定,进而减少心血管事件的发生,且早期降低LDL-C水平给患者带来的获益,远高于ASCVD发生后再降低LDL-C水平。
本文作者表示,“临床医生不会等患者出现肾损伤或脑血管事件后,才想到治疗高血压;不会等到患者肾衰竭或视网膜出血,才想到控制高血糖;不会等到患者发生肺炎或蜂窝织炎,才想到使用抗生素;不会等到关节损伤,才想到治疗类风湿性关节炎。但相比之下,降低LDL-C,提高HDL-C水平却往往是在心血管事件发生后”。
目前,临床上常用降低LDL-C药物主要有他汀、胆固醇吸收抑制剂、PCSK9抑制剂等。
他汀类药物主要通过竞争性抑制内源性胆固醇合成限速酶3-羟基-3甲基戊二酰辅酶A还原酶,阻断细胞内羟甲戊酸代谢途径,减少肝细胞内胆固醇的合成。PACMAN-AMI试验表明,当受试者单用他汀类药物或是与阿利库单抗联用,LDL-C水平可降低至50 mg/dl以下。胆固醇治疗试验合作组对27项临床试验中超过17.4万既往患有或未患心血管疾病的受试者进行分析,发现使用他汀类药物治疗的人群, LDL-C水平每降低1 mmol/l(38.67 mg/dl),不良心血管事件发生率可降低约22%。
依折麦布是常见的胆固醇吸收抑制剂,主要通过肠道膜转运蛋白尼曼-匹克C1型类似蛋白1结合有效抑制外源性胆固醇的吸收。IMPROVE-IT研究证实,依折麦布联合他汀类药物可强化降低LDL-C水平,可进一步降低心血管事件发生风险。
PCSK9抑制剂通过结合PCSK9,拮抗PCSK9对LDLR的降解,增加肝脏LDLR对LDL的结合、摄取和利用。FOURIER、ODYSSEY-OUTCOMES研究均证实,在他汀类药物基础上联用PCSK9抑制剂依洛尤单抗,可进一步降低LDL-C水平,以及主要心血管风险事件的发生率。
防治ASCVD,LDL-C水平越低越好
从ASCVD发生原理来看,体内LDL等脂蛋白颗粒进入内膜后不能及时离开,导致血管内皮下脂质蓄积,加上免疫应答、炎症等作用因素,最终开始了动脉粥样硬化的形成。因此,仅LDL-C水平升高就可以引起ASCVD。
理论上,LDL-C水平保持在20~40 mg/dl,则不容易发生ASCVD,这一水平基本与新生儿期一致。基于LDL-C水平与急性ASCVD风险事件对数线性关系也显示,若LDL-C水平保持在38 mg/dl或1 mmol/l时,不会有额外心血管事件发生风险。但过往Bogalusa Heart研究、PDAY研究、The Tromso研究都提示,随着年龄的增长,LDL-C水平会随之增加,Cooper研究提示,即使LDL-C基线水平<100 mg/dl,在平均随访的26.5年间,冠心病死亡风险也会持续升高,要长期将LDL-C水平保持在与新生儿期一致的“理想状态”比较困难。
因此,基于LDL-C水平随着年龄增长而增加带来的不良影响,预防ASCVD最核心的策略还是降低LDL-C水平,并维持终身。但LDL-C水平降低到何种水平为佳?有没有最低限制?
事实上,LDL-C水平越低,发生ASCVD的风险也越低,患者发生并发症越少,且无论LDL-C水平降低到何种水平,均无证据表明会对身体造成显著损害。过往JUPITER、FOURIER、ODYSSEY-OUTCOMES等多项研究均证实,即使对LDL-C水平维持在70~100 mg/dl的人群,进一步降低LDL-C水平也可带来额外的心血管获益。FOURIER、ODYSSEY研究还指出,LDL-C水平低于20 mg/dl,不良事件发生率也未高于安慰剂组,即使LDL-C水平低于10 mg/dl,也不会增加痴呆、出血性脑卒中、肿瘤等疾病发生风险。
孟德尔随机化试验也支持了上诉观点,LDL-C水平不受遗传多态性影响,LDL-C水平越高,ASCVD发生风险就越高,水平越低,发生风险也越低。
心血管疾病存在“风险悖论”,即危险因素水平更高的人患心血管疾病风险更高,但多数心血管疾病事件发生于中低风险的人群中。ASCVD的治疗同样存在“悖论”,ASCVD是可防可治的慢性病,但仍然是全球范围内致残和致死的主要原因。
基于动脉粥样硬化性心血管疾病临床实践现状,本文作者提出了相关预防和治疗建议:
重视ASCVD的早期预防和筛查
ASCVD很大程度上属于生活方式疾病,主要危险因素有总胆固醇(TG)或LDL-C、高密度脂蛋白胆固醇(HDL-C)、高血压、糖尿病、吸烟等。针对危险因素采取积极有效的预防措施,是降低ASCVD死亡率的基石。ASCVD发生风险与LDL-C水平、暴露持续时间成正比,所以LDL-C水平越早降低越好,每位患者都应接受单独且全面的评估,以了解引起ASCVD发生的所有风险因素。
需重视ASCVD的筛查,且筛查的时间越早越好,出生后即开始筛查效果更好:
第一年:建议检测脂蛋白(a)和LDL-C水平,这两项指标异常会增加儿童中风风险,如有异常,需尽快开展治疗;8年内,做一个完整的脂质检查,如果提示有家族性高胆固醇血症(FH)风险,需要立即与儿科医生联系处理。除FH外,若不存在明显相关风险因素且LDL-C水平<85 mg/dl,可能需要改变既往生活方式,定期随访有助于及时发现异常变化。若存在有明显相关风险因素,则健康的生活方式管理至少需要持续6个月时间,6个月后依然无法改善体重、血脂等因素,8岁起就可能要考虑使用他汀类药物和依折麦布;若评估患儿患病风险极高,可以考虑在患儿年龄更小的时候就开始治疗,但这与患儿个体情况和临床医生判断有关。
开始干预起始年龄为13岁:
若既往LDL-C水平未>85~100 mg/dl且无明显相关风险因素,可每年定期观察,鼓励采取健康的生活方式;
若改变生活方式后无法逆转内膜增厚、斑块,或是降低相关风险因素发生,需要考虑更为积极的干预;
年轻人也可能有斑块,不过多数20~50岁人群不符合治疗指征,可以考虑早期筛查斑块,及时发现异常。通过B超检测颈动脉内膜厚度(CIMT),也有助于早期发现动脉粥样硬化,条件允许情况下,可以考虑用3D超声持续检测颈动脉斑块的进展。除了B超,如果评估患者患病风险很高,必要时考虑做CT血管造影和(或)MRA,但冠状动脉钙化评估仅限于年龄>40岁以上患者。若已经在主动脉、股动脉等处发现斑块,意味着可能已经进展为晚期动脉粥样硬化;
已经有斑块,则LDL-C控制目标应设定为<38 mg/dl,同时需要控制所有已经发现的相关风险因素;
多数情况下,ASCVD高风险人群的LDL-C控制目标,可能要设定为<20 mg/dl。
合理控制LDL-C水平是避免ASCVD发生的关键
若个体满足以下情况,不容易发生动脉粥样硬化,除非后续发展到出现斑块,否则保持健康的生活方式即可,无需采取药物治疗,但每年需评估患病风险。
过往LDL-C水平未>85 mg/dl;非LDL-C水平<100 mg/dl;不存在可能增加动脉粥样硬化发生的风险因素;身体健康且生活方式健康。
若患者存在以下一种或几种情况,需要采取相应治疗措施,以阻止内膜持续改变:
LDL-C水平>100 mg/dl或非LDL-C水平>110 mg/dl;出现斑块;存在显著增加动脉粥样硬化发生的风险因素;患有ASCVD。
女性患者需要更加注意:
女性怀孕、孕期并发症、更年期、患有多囊卵巢综合症等女性特有疾病,容易增加胆固醇水平升高风险,患病风险更高;即使是怀孕后发现患病,立即开始干预治疗,不影响后期的母乳喂养和再次生育。
参考资料
[1] There is urgent need to treat atherosclerotic cardiovascular disease risk earlier, more intensively, and with greater precision: A review of current practice and recommendations for improved effectiveness. Am J Prev Cardiol. 2022 Aug 6;12:100371. doi: 10.1016/j.ajpc.2022.100371. PMID: 36124049; PMCID: PMC9482082.
[2] Long-term association of low-density lipoprotein cholesterol with cardiovascular mortality in individuals at low 10- year risk of atherosclerotic cardiovascular disease. Circulation 2018;138: 2315–25.
[3] Cholesterol-years” for ASCVD risk prediction and treatment*. J Am Coll Cardiol 2020;76:1517–20.
[4] Relation of serum lipoprotein levels and systolic blood pressure to early atherosclerosis. The Bogalusa heart study. N Engl J Med 1986;314:138–44.
[5] Pathobiological determinants of atherosclerosis in youth (PDAY) risk score in young adults predicts coronary artery and abdominal aorta calcium in middle age. Circulation 2016;133:139–46.
[6] Cohort profile: the Tromso Study. Int J Epidemiol. 2012 Aug;41(4):961-7.
[7] Effect of alirocumab added to high-intensity statin therapy on coronary atherosclerosis in patients with acute myocardial infarction: the PACMAN-AMI randomized clinical trial. JAMA 2022;327: 1771–81.
[8] Efficacy and safety of LDL-lowering therapy among men and women: meta-analysis of individual data from 174, 000 participants in 27 randomised trials[J]. Lancet, 2015, 385(9976): 1397-1405.
[9] Ezetimibe added to statin therapy after acute coronary syndromes[J]. N Engl J Med, 2015, 372(25): 2387-2397. http://www.nhc.gov.cn/ewebeditor/uploadfile/2018/12/20181225162117736.docx
[5] 中国抗癌协会胰腺癌专业委员会, (2021).中国胰腺癌综合诊治指南(2020 版). 中华外科杂志, DOI:10.3760/cma.j.cn112139-20201113-00794.
标签: 心血管





